行业洞见
获批抗体药及适应症
1986年美国FDA批准第一款单克隆抗体药物-单抗OKT3,至今已经近百款抗体药物获得FDA的批准上市。近年来,在FDA每年批准的新药中,抗体药物占据了约1/5的份额。这些款抗体药物对应的适应症中,肿瘤治疗仍是主流,其次是皮肤科和血液疾病。商业化抗体产品表现出靶点相对集中,居第一的是PD-1/L1,紧随其后是CD20、TNF、HER2等热门靶点。

新药研发现状
药物研发的主要有三大特点:
- 耗时长
- 成功率低
- 投入高
新药从研发到上市的全流程需要约10年时间,花费近10亿美元。据数据统计,仅约12%的临床试验项目能够最终获批FDA。同商业化抗体产品类似,新药研发阶段也显示同一问题,即靶点相对集中。

抗体药物未来发展
随着抗体技术得到不断更新,基于单克隆抗体衍生了越来越多的抗体药物,例如ADC、双抗、抗体片段、以及纳米抗体等等。全球范围内已上市的双抗有四种,ADC药物有14款。国内不少企业开始入局新型抗体药物研发赛道,随着抗体药物的发展,抗体药物的审批速度也将越来越快,未来将看到大批抗体药物集中上市。
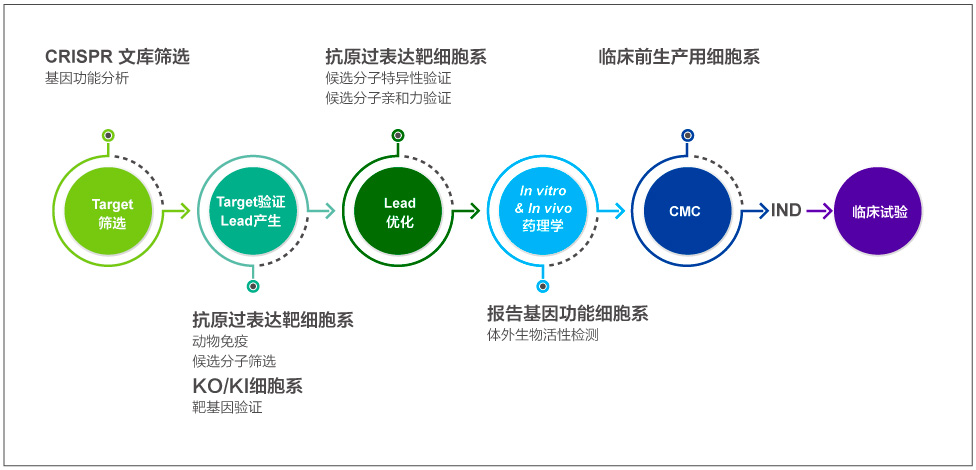
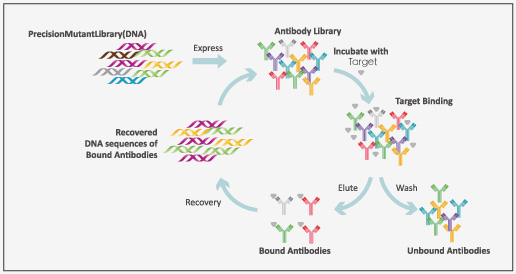
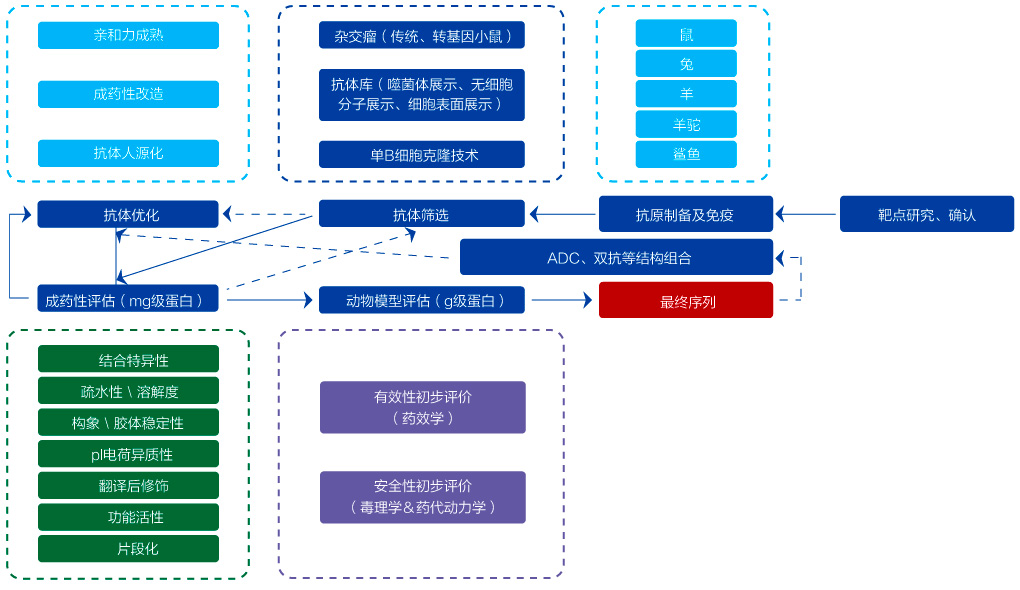
抗体药研究阶段开发流程
生物医药从业者面临的问题
-

靶点发现与转化率低
-

药物研发投入与风险控制压力大
-

候选药物安全性与效力预测失败率高
-

药物开发项目决策难
金斯瑞建立了从高通量靶点筛选、抗原和抗体制备、细胞系开发、高通量表达及ELISA试剂盒开发等一系列技术平台,提供从靶点发现、先导抗体产生和优化、功能鉴定与分析等解决方案,匹配不同阶段需求,为生物药研发提供加速动力。
靶点发现
药物靶点的筛选是药物开发过程中的重要环节,靶点筛选的成功与否直接影响到后期药物的相关研究,采取何种靶点筛选策略成为研发人员关注的焦点。在靶点发现过程中,往往需要解决以下问题:靶点分子与上下游通路的作用机制;靶点分子相关基因与转录水平特征的分析;在获得抗原蛋白的过程中,如何克服难度蛋白的制备问题。金斯瑞技术平台可以提供从分子基因的表达质粒构建到高通量文库筛选方案,以及靶分子制备的定制方案,帮助全球科学家快速推进靶点发现进程。
高通量靶点筛选-gRNA文库
金斯瑞基于CRISPR技术和oligo pool开发出全基因组 gRNA文库,用于高通量基因编辑,实现高通量的靶点筛选或功能性基因筛选。
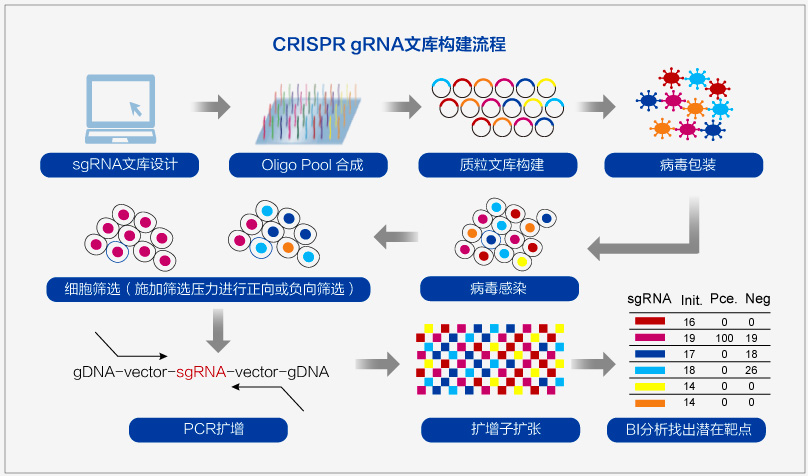
金斯瑞案例:
订单: 12,000条核苷酸序列的引物池,长度125mer
金斯瑞方案: 12K芯片,半导体技术合成,一周内交付,合成后小量扩增
QC检测: NGS测序
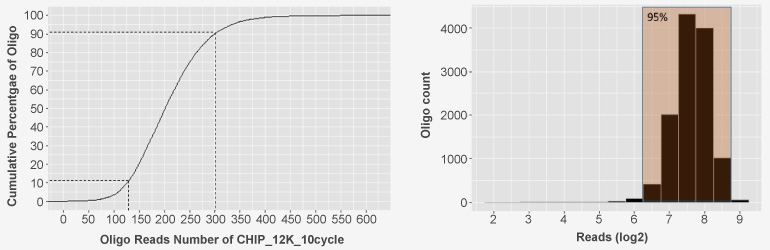
检测结果:
-

12,000条自定义Oligo均匀分布
-

99.74%覆盖率

0.27%碱基错误率

均一度:90% / 10% < 2.5
金斯瑞现货供应,针对Human和Mouse全基因组范围的CRISPR基因敲除(GeCKO)gRNA文库和转录激活(SAM)gRNA文库,实现全基因范围内功能基因的高通量快速筛选。同时金斯瑞还可以按照需求为客户合成由Broad研究所预先设计和验证的gRNA序列,基因靶点由药物基因交互数据库确定,靶向筛选特定通路的Pathway-focused gRNA文库 。
先导抗体产生
当靶点确认后,生物药研发项目进入到先导抗体产生阶段。金斯瑞提供从多肽、蛋白分子等抗原制备、动物免疫及筛选到抗体表达纯化等一站式先导抗体生产。
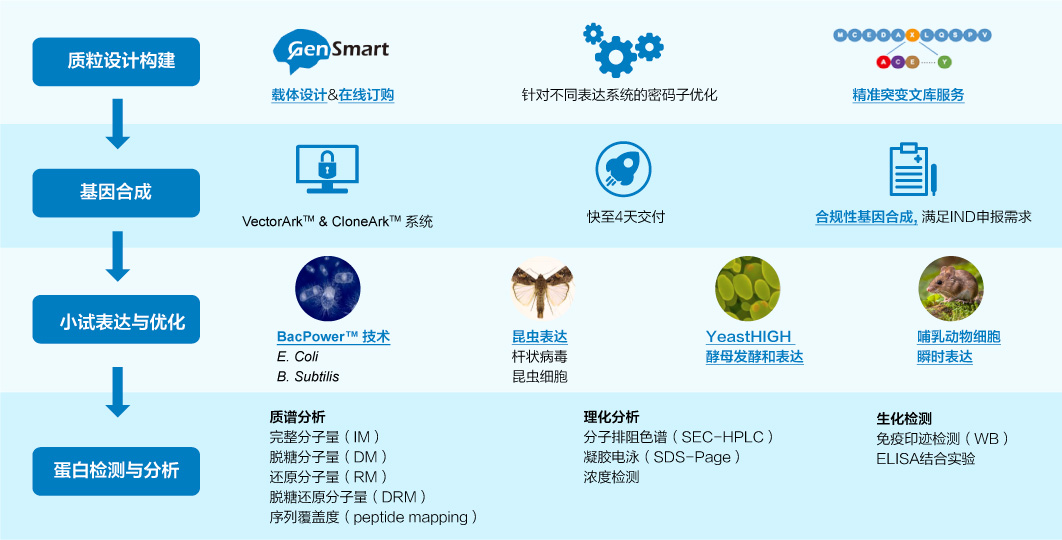
抗原制备
金斯瑞拥有超19年多肽合成和蛋白表达经验,根据项目需求提供定制化抗原制备,完善的质控体系,快速交付。
靶蛋白制备流程
动物免疫及筛选
三大抗体开发平台-鼠杂交瘤平台、兔B细胞克隆平台及单B细胞筛选平台
| 鼠杂交瘤平台 | 兔B细胞克隆平台 | 单B细胞筛选平台 | |
|---|---|---|---|
| 抗体来源 | 脾细胞 | 记忆B细胞 | 记忆B细胞 |
| 克隆数 | ≤ 20个克隆 | 50 - 100 个克隆 | > 100 个克隆 |
| 多样性 | 中等 | 高 | 较高 |
| 特点 |
|
|
|
金斯瑞案例:
-

杂交瘤技术平台
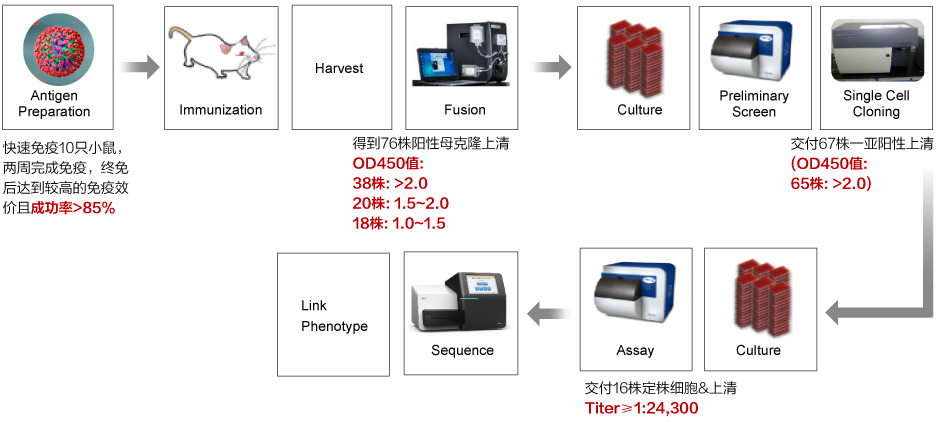
-

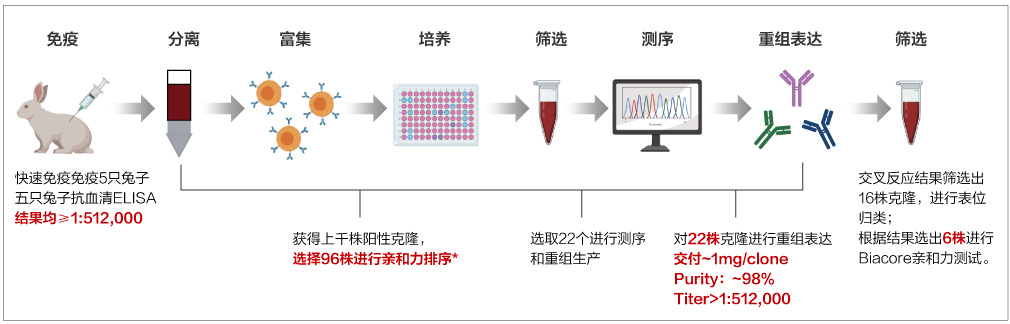
B细胞克隆技术平台
案例1:在新冠抗体开发中,兔单抗平台能高效获得阳性克隆
案例2:兔单抗高效制备具有交叉识别能力的抗体
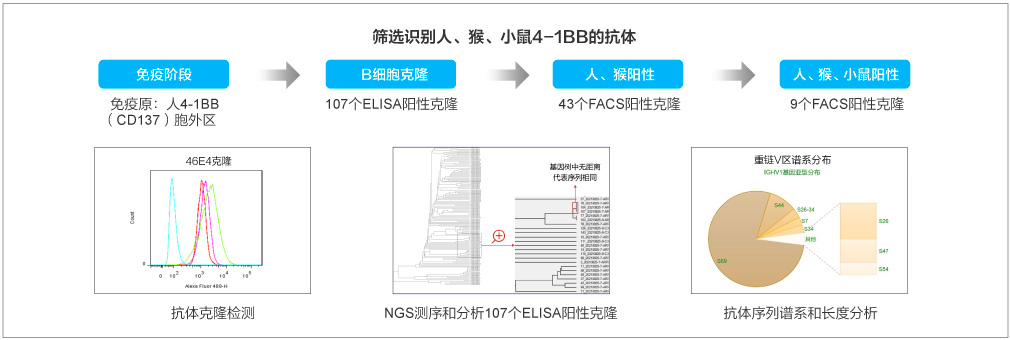
结果:筛选方案为4-1BB胞外区ELISA+细胞ELISA+FACS,测序与重组表达验证,重组阳性率33/43=76.7%。
-

Beacon®平台高通量自动化细胞筛选
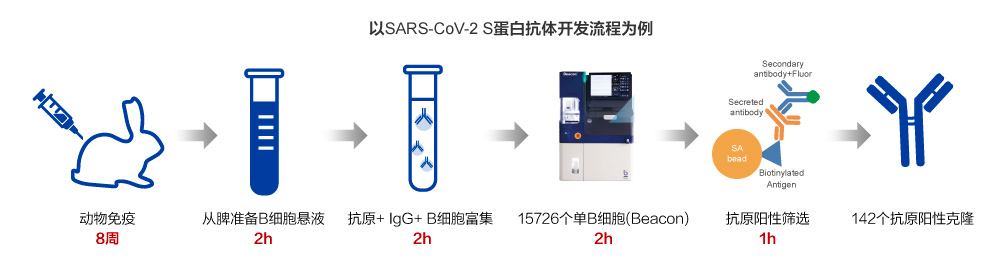
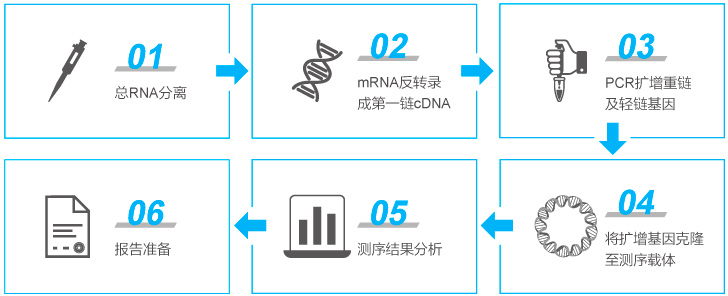
抗体测序
快速筛选-Gene to Plasmid
无论是杂交瘤平台还是B细胞克隆技术,最终获得的候选分子序列需要进行重组抗体的表达与制备,进一步筛选和验证。如何进行经济高效地构建表达质粒是生物药研发过程必须解决的问题,金斯瑞Gene to plasmid服务帮助研究者更快速经济地筛选表达抗体。金斯瑞Gene to Plasmid服务快至7天交付,相比常规基因合成+质粒服务业务周期缩短一倍,快人一步、领先一路!
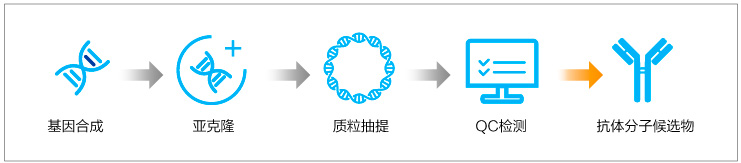
-

快速交付
短至7天 -

免费建立
独立载体库 -

高通量平台
稳定交付 -

信息安全
IP保护
先导抗体优化
高通量、快速筛选亲和力成熟抗体-精准突变文库
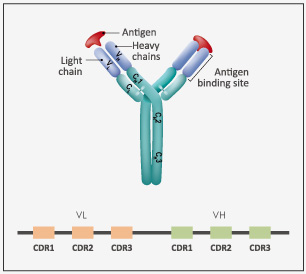
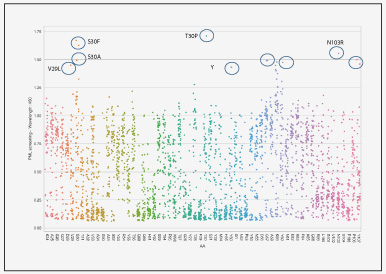
从天然抗体库中筛选得到的抗体通常亲和力较低,不足以满足治疗性需要。研究人员在得到候选分子后,通常需要对先导抗体进行优化和改造,包括人源化、嵌合,序列定向进化等,较大程度提高抗体的亲和力,降低异源免疫原性,提高抗体的稳定性和安全性等。
针对目标抗体的轻链和重链的靶向CDR区域,金斯瑞提供完整的突变文库用于亲和力成熟。在金斯瑞以往案例中,重链和轻链上6个CDR区共包含63个突变位点,通过精准扫描饱和突变将每个野生型的氨基酸密码子突变为其他19种氨基酸的密码子,得到多个高亲和力突变体,其中最高可达4个数量级。不同阶段利用不同类型的精准突变文库能够高效提升抗体亲和力成熟。
更多文库信息>>>
高通量抗体瞬时表达
在候选抗体优化过程中,需要同时表达多个候选抗体进行多次验证。依托金斯瑞高通量基因合成服务和高效的瞬时抗体表达技术,金斯瑞高通量重组抗体表达平台 ,从基因合成至蛋白或抗体,快至6个工作日交付,且三重QC检测保证交付质量!项目流程经二维码监控,全程可追溯,并且在生物安全法出台的情况下,金斯瑞可提供更规范和全面的材料支持,为下游研发提供全面的支持。
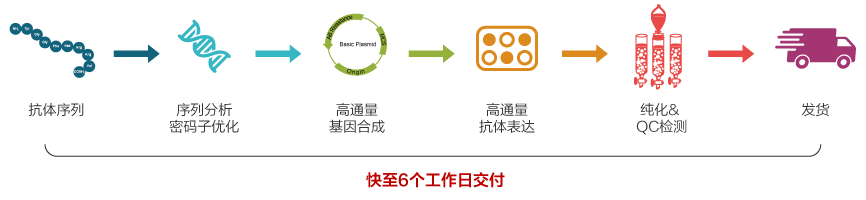
金斯瑞案例:
Covid-19 相关抗体筛选
表达体系:4ml,序列数量:40个
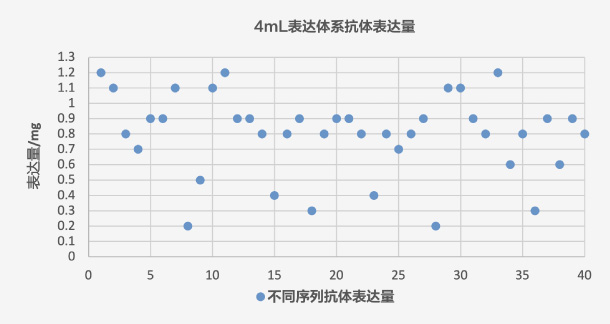
结果:
抗体药研究阶段开发流程~65% 的序列表达量≥200mg/L,个别序列表达量偏低,满足客户筛选要求
抗体稳定表达- 细胞系服务
在获得候选克隆之后,通常需要构建稳定细胞系,这是抗体药物研发过程中一个必不可少的工作。金斯瑞细胞系开发服务包括组成型过表达、诱导型过表达和报告细胞系,金斯瑞技术团队拥有250+靶细胞经验,提供多种转染或感染方式及检测方法,满足客户不同阶段项目需求。

功能验证与分析
在生物药物的临床前研发中,一旦确定抗体药物的分子形式并在哺乳动物细胞中表达出抗体蛋白分子后,需要对得到的抗体进行功能验证、成药性评估(mg级抗体)、动物模型评估(g级抗体)等一系列分析。这些所有的功能验证与分析均需要大量的抗体,那如何获得足够的接近天然状态的抗体?金斯瑞提供基于CHO表达系统的克级抗体表达。同时还提供适用于CMC级别的ELISA试剂盒开发。
克级抗体瞬时表达-CHO表达平台
哺乳动物细胞表达系统对于翻译后修饰和折叠蛋白的表达至关重要,CHO细胞是常见的表达重组抗体/蛋白的宿主细胞,金斯瑞CHO细胞瞬时转染平台提供40mL-200L表达体系,快至3周交付克级抗体分子。
-

CHO表达系统
商业化生产细胞系
一致性好 
周期短
快至3周,交付克级抗体分子
40~200L表达体系灵活选择
严格质控
业内高质量抗体交付
全程样品唯一二维码追溯,零错误
高表达量
常规抗体平均表达量达400mg/mL
金斯瑞案例:

案例1:不同抗体类型在CHO-HT,CHO Express和CHO HP表达量统计
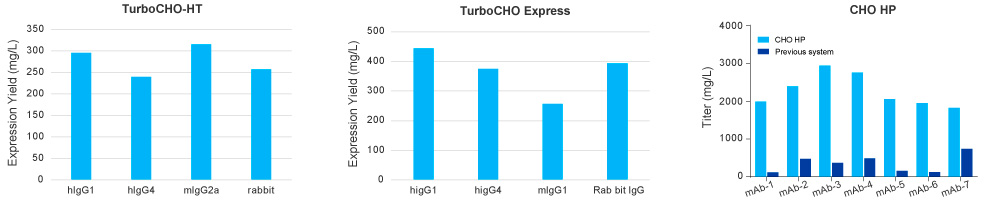
案例2:不同抗体类型在CHO平台表达情况
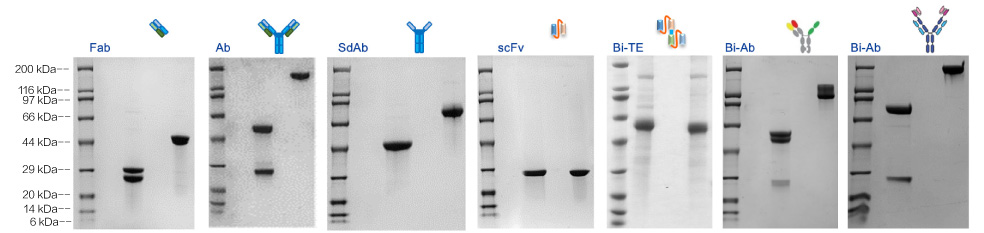
结果:
CHO-Express平均表达量为544mg/mL,超过88%的项目的表达量≥200mg/mL
ELISA 试剂盒开发
ELISA试剂盒贯穿生物药开发和申报流程,金斯瑞提供多种ELISA试剂盒开发服务,包括ADA试剂盒、HCP试剂盒、PK试剂盒及常规试剂盒。

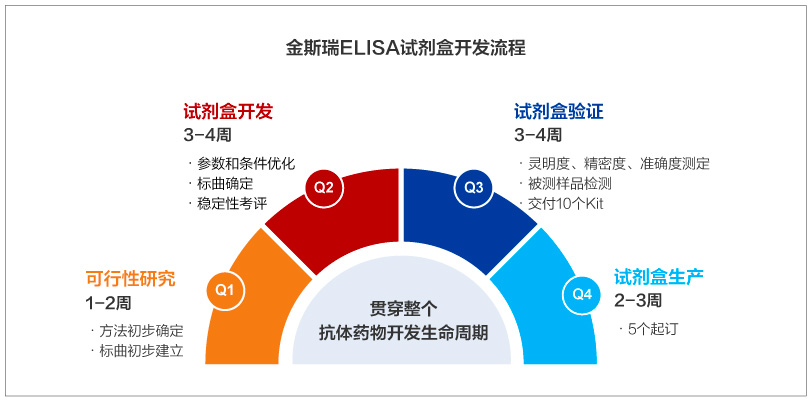
金斯瑞案例:
PK试剂盒开发
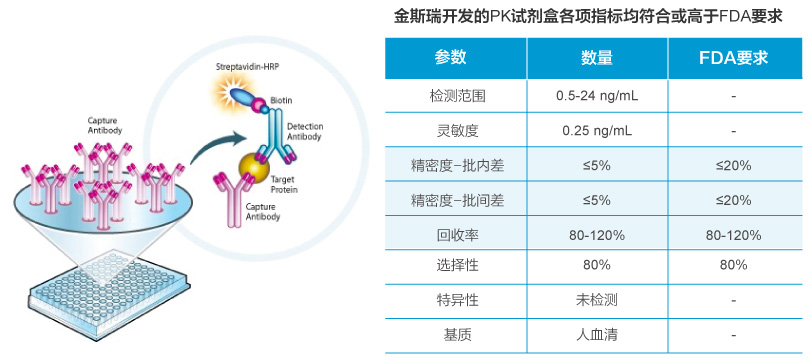
结果:
我司开发的ELISA PK试剂盒参数均高于或等于FDA《生物分析方法指导》的要求
靶点验证、体外活性-细胞系服务
基于CRISPR技术的细胞系在靶点发现阶段可根据细胞表型的变化,确定作用靶点或者制备膜蛋白靶点的细胞用于抗体药的筛选。在获得靶点后,可以利用细胞系进行功能分析得到Leads。体内外的药理学分析过程中,细胞系可以用于药物功能的验证。总之,基于CRISPR的细胞系服务贯穿于抗体药研发的始终,是抗体药开发的强有利工具。